На кафедре биофизики создали новую теорию механизма сборки цитоскелетных микротрубочек
Учёные физического факультета МГУ совместно с американскими коллегами из Университета Колорадо открыли новый механизм сборки микротрубочек и проанализировали причины их необычного бистабильного поведения в клетке. Результаты опубликованы в журналах Journal of Cell Biology и Plos Computational Biology. Первая публикация вошла в престижную коллекцию «цитируемых статей по структурной клеточной биологии, вышедших в журнале Journal of Cell Biology за последние годы». Исследования поддержаны грантом Российского научного фонда (РНФ). Прогресс в понимании молекулярных механизмов работы микротрубочек может вывести разработку лекарств от рака на качественно новый уровень.
«Основным объектом нашего исследования были микротрубочки, образующие внутренний скелет живой клетки. Микротрубочки состоят из димеров белка тубулина и динамически заполняют клетку за счет необычного свойства — способности спонтанно переключаться от сборки к разборке. Благодаря этому, они выполняют множество функций, в том числе находят хромосомы во время клеточного деления и распределяют генетический материал между дочерними клетками», — объясняет руководитель проекта, старший научный сотрудник кафедры биофизики физического факультета МГУ кандидат физико-математических наук Никита Гудимчук.
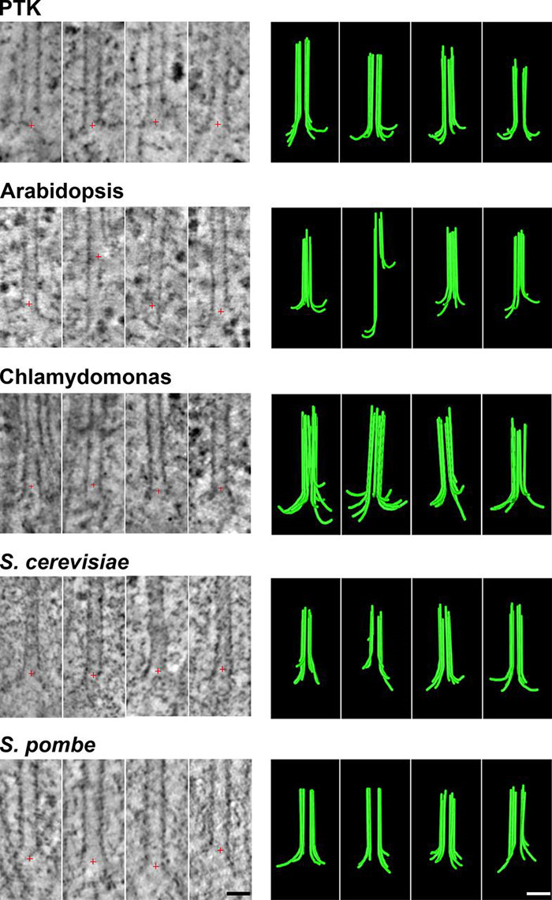
В цитоплазме клетки белки тубулины связаны с молекулами гуанозинтрифосфата (ГТФ). Комплексы ГТФ и тубулина встраиваются в концы микротрубочек, удлиняя их. Вскоре после встраивания, однако, происходит химическая реакция превращения молекулы ГТФ в кармане тубулина в молекулу гуанозиндифосфата (ГДФ). Поэтому большая часть микротрубочки состоит из тубулинов, связанных с ГДФ, а ГТФ-тубулины обнаруживаются лишь на концах микротрубочек, создавая там стабилизирующую зону. Потеря ГТФ-тубулинов с концов микротрубочек приводит к быстрой разборке микротрубочек. Ранее считалось, что причиной этого является разная кривизна тубулинов в комплексе с ГТФ и ГДФ. В частности, ГТФ предполагался более прямым и поэтому «более подходящим» для построения микротрубочки, а ГДФ-тубулин — более изогнутым. Эта модель подразумевала разный вид концов микротрубочек во время сборки и разборки.
Используя криоэлектронную томографию ученые, наоборот, обнаружили, что концы микротрубочек всегда состоят из изогнутых протофиламентов, подразумевая, что различие между ГТФ- и ГДФ-тубулинами кроется не в их кривизне. Чтобы объяснить эти данные, ими была предложена новая модель сборки микротрубочки, согласно которой удлинение микротрубочки происходит за счет смыкания изогнутых нитей тубулина на растущем конце, которые часто выпрямляются и смыкаются благодаря тепловым колебаниям. Детальное полно-атомное моделирование таких нитей с помощью метода молекулярной динамики в соавторстве с коллегами биологического факультета МГУ, подтвердило сходство кривизны ГТФ- и ГДФ тубулинов. Авторы пришли к выводу, что присутствие молекулы ГТФ внутри тубулина делает связь между его димерами более гибкой, позволяя легче встраиваться в тело микротрубочки, несмотря на присущую этому белку кривизну. Это дает новый молекулярный механизм для переключения микротрубочек от сборки к разборке.
Полученные результаты имеют существенное значение как для фундаментального понимания регуляции микротрубочек и зависимых от них процессов в клетках, так и для медицины. Остановка динамики микротрубочек препаратами химиотерапии является одной из наиболее успешных стратегий блокирования деления раковых опухолей. Однако механизмы работы многих таких препаратов до конца не понятны, что затрудняет их рациональный дизайн и улучшение. В связи с этим, прогресс в понимании молекулярных механизмов работы микротрубочек может вывести разработку таких лекарств на качественно новый уровень.
Материал подготовлен в рамках проекта Наука-МГУ








