На физическом факультете МГУ предложили новый метод стимуляции нейронов с клеточным пространственным разрешением методами термогенетики
Ученые кафедры общей физики и волновых процессов физического факультета МГУ продемонстрировали комплексную техника термогенетических исследований* индивидуальных нейронов в культурах клеток и живых животных с использованием инфракрасного лазерного излучения. О своем исследовании сотрудники факультета рассказали в статье, которая была опубликована в журнале Nature.
«Результат наших исследований предоставляет необходимый набор методик и инструментов, позволяющий проводить исследования в области нейронаук с помощью термогенетических методов. Именно термогенетика представляет альтернативу широко распространенным в настоящее время оптогенетическим исследованиям. Идеологически термогенетика и оптогенетика сходны - оба метода требуют встраивание мембранных каналов в исследуемую клетку, активация которых приводит к стимулировании физиологического отклика клетки, например, генерации потенциала действия нейроном. Используемые каналы в оптогенетике (например, канал-родопсин ChR) обладают хромофором, поглощение фотона видимого излучения которым приводит к активации канала. Термоканалы же чувствительны к локальной температуре, а не к энергии кванта света. Поэтому преимущество термогенетики над оптогенетикой состоит в возможности использовать излучение инфракрасного спектрального диапазона. Свет в инфракрасной области спектра рассеивается и поглощается биотканями в значительно меньше степени, чем в видимой, что потенциально позволит неинвазивно стимулировать клетки, расположенные в глубоких слоях. Также инфракрасное излучение обладает меньшей фототоксичностью, чем используемый в оптогенетике свет видимого диапазона», рассказывает соавтор статьи, кандидат физико-математических наук, младший научный сотрудник кафедры общей физики и волновых процессов физического факультета МГУ Александр Ланин.
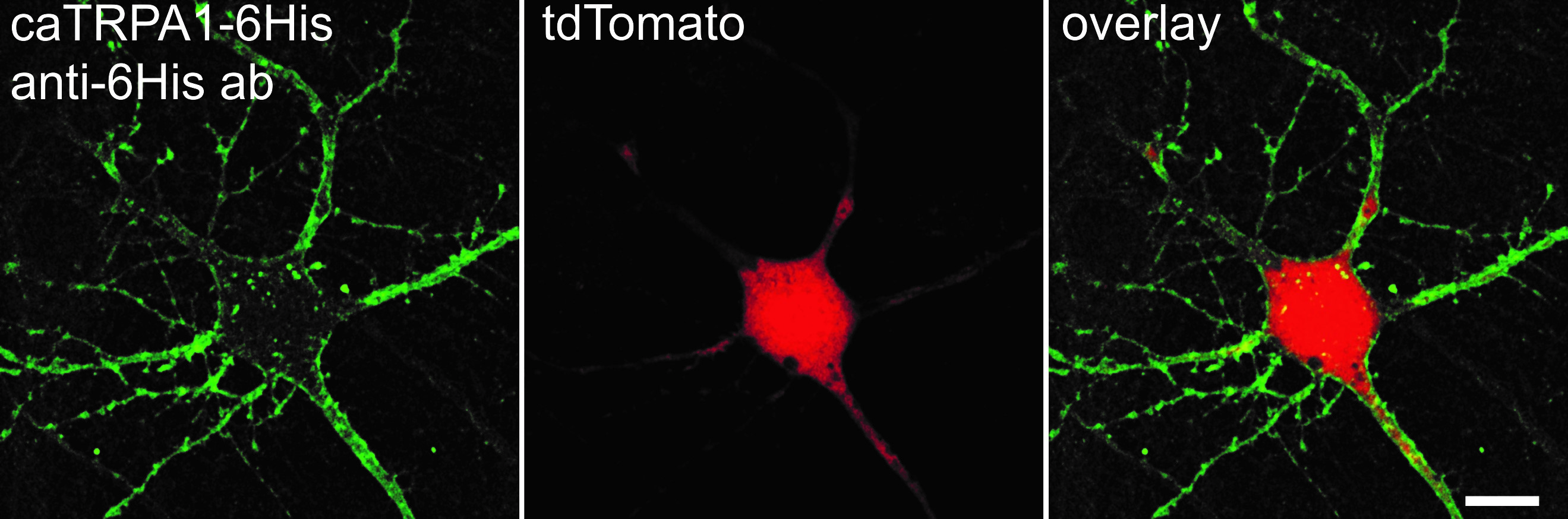
В работе демонстрируется методика быстрой, надежной и воспроизводимой адресной активации одиночных клеток в культуре и живом организме (in vitro и in vivo), экспрессирующих генетически встроенные термочувствительные каналы семейства TRPA1 с помощью перестраиваемого по длине волны инфракрасного лазерного излучения. В ходе работы были использованы чувствительные к теплу мембранные каналы caTRPA1 техасской гремучей змеи Crotalus atrox, активирующиеся при превышении пороговой температуры 28°С. Исследования показали, что такие термочувствительные каналы могут быть успешно экспрессированы нейронами рыбы и теплокровных животных.
 b)
b) 
«Управление и мониторинг локальной температурой в экспериментах с адресной активацией термочувствительных клеток являются основной задачей и особенностью наших исследований. Локальный нагрев клеток был реализован при помощи инфракрасного лазерного излучение. Правильный подбор параметров излучения (длина волны и энергия) позволяет активировать термочувствительные клетки в культуре и в живой рыбке Danio rerio. Эксперименты по термогенетической активации проводились с живыми трансфецироваными клетками Human Embryonic Kidney (HEK-293), HeLa, нейронами и эмбрионами рыбок Danio rerio. Клеточные культуры подвергались генной модификации с помощью векторов, которые встраиваясь в ДНК позволяют экспрессировать кальциевый индикатор GCaMP6s и термочувствительные каналы caTRPA1. Отклик биологической системы на лазерный нагрев полностью контролировался за счет оптической визуализации кальциевых токов и электрофизиологии. Одной из основных особенностей работы является создание и использование квантового термометрического зонда на основе волоконно-оптического/СВЧ волновода с квантовым сенсором (микрочастицей алмаза с дефектами азот-вакансия (NV-центрами), закрепленной на торце волнвода) для адресного измерения температуры с высоким (клеточным) пространственным разрешением (рис.1, средняя строка). Уникальные свойства реализованного зонда имеют большой потенциал для задач термогенетики, поскольку позволяет не только измерять температуру биологических объектов с высокой точностью и микронным (вплоть до субклеточного) пространственным разрешением, но и локально изменять температуру, тем самым реализуя возможность управления функциональной активностью термочувствительных клеток», - поясняет ученый.
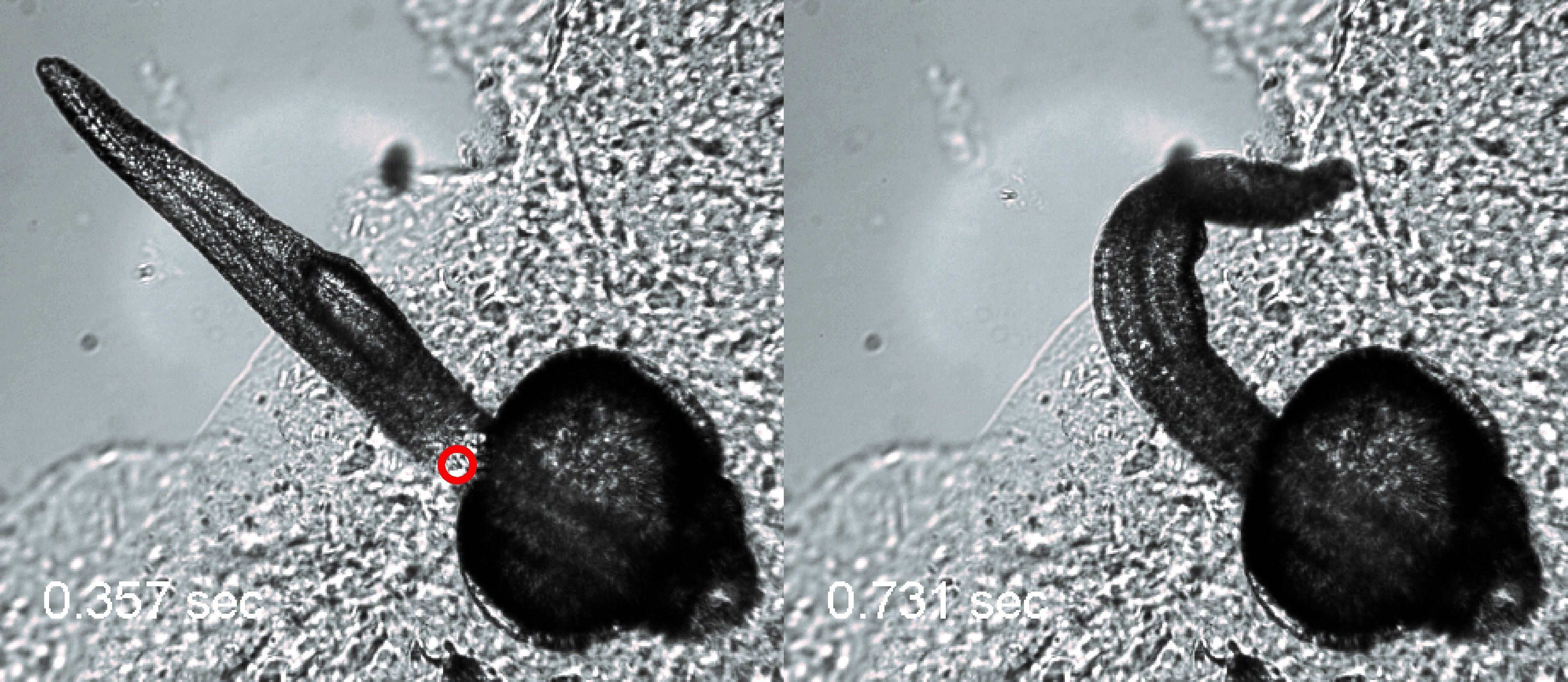
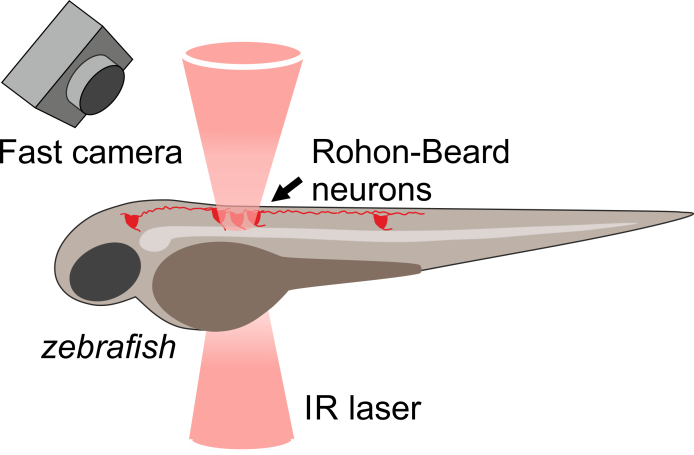
В работе была реализована серия поведенческих экспериментов на рыбке Danio rerio, в нейронах которой была осуществлена экспрессия термочувствительных каналов caTRPA1. Активация одного из группы этих нейронов (Rohon-Beard), расположенных на спинке рыбы, приводит к реакции убегания, проявляющаяся в резком ударе хвоста. Проведение флуоресцентной микроскопии позволило находить успешно трансфецированные нейроны, локальный нагрев которых осуществлялся импульсом инфракрасного излучения на длине волны 1342 нм длительностью 250 мс. Импульсный нагрев Rohon-Beard нейронов сопровождался ударом хвоста у трансфецированной рыбы, тогда как контрольная рыба (не обладающая каналами caTRPA1) не реагировала на лазерный нагрев.
Работа представляет результаты комплексного совместного исследования российских ученых из МГУ имени М.В. Ломоносова, Института биоорганической химии им (ИБХ РАН), Института высшей нервной деятельности и нейрофизиологии (ИВНД и НФ РАН).
Справочно: *Термогенетика - новая перспективная междисциплинарная область науки, суть которой заключается в принудительной и целенаправленной температурной активации физиологической деятельности клеток, в частности нейронов, за счет использования термочувствительных катионных каналов (TRP), генетически встроенных в мембраны этих клеток. До недавнего времени широкое применение этой техники было ограничено невысокой чувствительности известных термоканалов, а также низкого пространственно-временного разрешения методики их активации при стандартном нагреве среды или использовании химических агентов. Термогенетика обладает большими перспективами в области управления физиологической активностью клеток. Методы термогенетики не привязаны к спектрам поглощения хромофоров, лежащих в видимой области спектра, как это реализовано в оптогенетике. В связи с этим возникает возможность выбирать центральную длину волны лазерного излучения в окне прозрачности биологической ткани для осуществления стимуляции глубоких слоев. Используемые нами термочувствительные каналы caTRPA1 змеи не являются селективными по ионам, поэтому обладают проводимостью на несколько порядков превышающую проводимость популярных каналов семейства канал-родопсин ChR оптогенетики. Каналы caTRPA1 осуществляют в основном ток катионов кальция через мембрану, что позволяет управлять распространенной в живых организмах системой сигналинга, основанной на концентрации катионов кальция. На сегодняшний момент с этой задачей методы оптогенетики справляются плохо. На практике это может быть реализовано как малоинвазивная стимуляция тканей (нейронов, клеток сердца, клеток надпочечников и т.д.) для активации или ингибирования физиологического ответа клеток.








