Сотрудники молодежной лаборатории физических методов биосенсорики и нанотераностики предложили новый способ лечения рака
Лаборатория физических методов биосенсорики и нанотераностики создана на физическом факультете МГУ по программе «Зеленый свет» в январе 2018 г.

Основными научными направлениями лаборатории являются:
• Разработка биосовместимых нанороботов, активируемых с помощью ультразвука или электромагнитного излучения, для тераностики (одновременной терапии и диагностики) онкологических заболеваний;
• Разработка высокочувствительных нано-биосенсоров для качественного и количественного экспресс-анализа микроорганизмов в окружающей среде, а также маркеров социально-значимых заболеваний;
• Разработка антибактериальных и противовирусных агентов на основе наночастиц и композитных наноструктур.
Сотрудниками лаборатории с момента ее открытия уже опубликовано 17 статей в ведущих журналах.
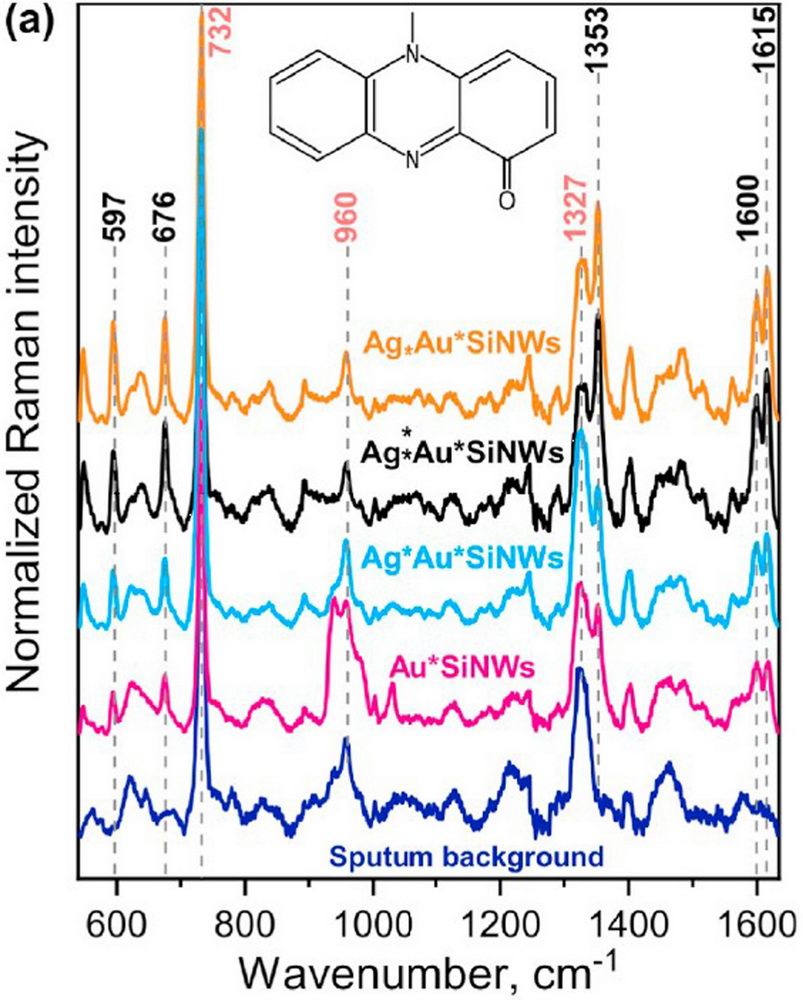
В сентябре 2019 г в высокорейтинговом журнале Talanta опубликована работа “Rapid detection of the bacterial biomarker pyocyanin in artificial sputum using a SERS-active silicon nanowire matrix covered by bimetallic noble metal nanoparticles”, в которой впервые показана возможность детектирования инфицирования человека синегнойной палочкой с помощью разработанного сотрудниками лаборатории ГКР-активного нано-биосенсора.
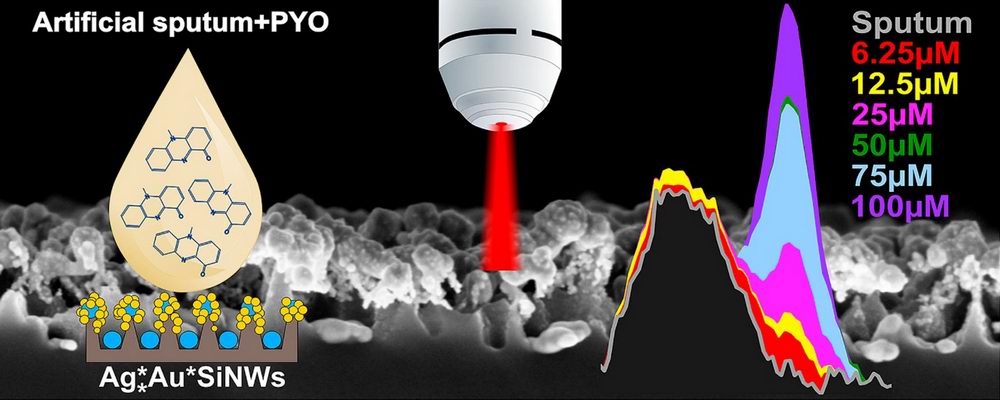
Схематическое изображение методики детектирования синегнойной палочки с использованием ГКР-активных композитных нанострукту [Talanta].
Синегнойная палочка является резистентной ко многим антибиотикам и антисептикам грамотрицательной палочковидной бактерией. Обнаружить наличие синегнойной палочки в организме помогает то, что эта бактерия продуцирует характерные пигменты в ходе своей жизнедеятельности (в частности, пиоцианин). При заболеваниях бронхолегочной системы пиоцианин локализован в легких больного человека и может быть диагностирован из мокроты.
|
Детектирование пигмента бактерии стало возможным благодаря разработанному в лаборатории наноструктурированному ГКР-активному материалу. Эффект ГКР (гигантское комбинационное рассеяние) заключается в усилении на несколько порядков сигнала комбинационного рассеяния света от молекул, адсорбированных на наноструктурированных поверхностях благородных металлов. В лаборатории были впервые синтезированы структуры, представляющие собой подложку из кремниевых нанонитей, декорированных биметаллическими наночастицами серебро@золото. При воздействии лазерного излучения на молекулы пиоцианина, сорбированные на наноструктурированную подложку, удалось в десятки раз усилить сигнал от исследуемых биомолекул за счет эффекта ГКР. Селективность сигнала обуславливалась |
|
|
Спектр КРС молекул пиоцианина, адсорбированных на поверхность нанонитей кремния, покрытых наночастицами Ag@Au. [Talanta]. |
наличием уникальных пиков — «отпечатков пальца» молекул анализируемого вещества в регистрируемом спектре. При этом характерные пики были разрешимы вплоть до концентрации пиоциаина в мокроте 6,25 мкМ, что соответствует нижней границе концентрации бактерий в мокроте больного человека. Таким образом, разработанный наноматериал позволяет не просто быстро и точно обнаружить присутствие молекул пиоцианина, но и определить их концентрацию в мокроте, что крайне важно для идентификации стадии заболевания.
В октябре 2019 г в высокорейтинговом журнале ACS Biomaterials Science & Engineering опубликована работа “Biodegradable porous silicon nanocontainers as an effective drug carrier for regulation of the tumor cell death pathways”, в которой сотрудники лаборатории в содружестве с коллегами с факультета фундаментальной медицины МГУ и института фотонных технологий Германии впервые продемонстрировали возможность направленного регулирования гибели раковых клеток с использованием наноконтейнеров на основе пористого кремния, загруженных противоопухолевым лекарством.
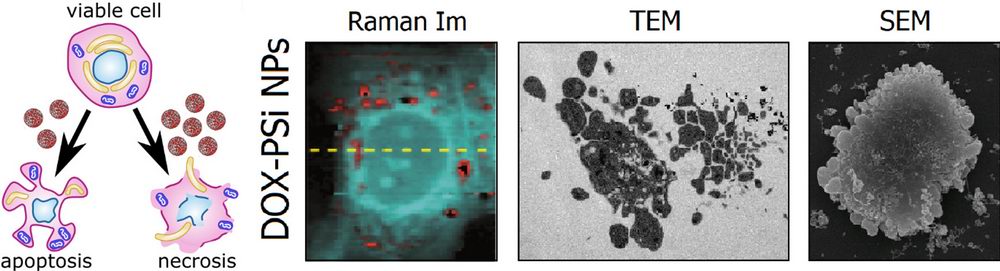
Слева направо: схема гибели клеток по механизму апоптоза или некроза, активированных наноконтейнерами на основе пористого кремния: Оптическое изображение раковой клетки MCF-7, внутри которой находятся наноконтейнеры с лекарством (красные споты), восстановленное по спектрам комбинационного рассеяния света; Просвечивающая электронная микроскопия (TEM) и сканирующая электронная микроскопия (SEM) раковой клетки после воздействия наноконтейнеров [ASC BioSciEng, 2019]. .
Наномедицина в настоящее время является одной из наиболее динамично развивающихся областей исследований. Инновационные диагностические и терапевтические методы, которые могут быть достигнуты с использованием нанотехнологий, поднимают современную медицину на новый высокий уровень. Лекарство, загруженное в наноконтейнеры, может быть доставлено в нужное место и в нужное время, тем самым терапевтический эффект проявляется только в зоне локализации заболевания, а побочные воздействия на здоровые клетки и ткани нивелируются. Доставка с помощью наноконтейнеров может изменить фармакодинамику и фармакокинетику лекарственного препарата.
Нарушение программы гибели является одним из свойств устойчивости раковых клеток к лечению. Поскольку клетка может погибнуть по нескольким механизмам, важно не только уничтожать нежелательные клетки, но и регулировать по какому механизму они наиболее эффективно способны исчезнуть. Апоптоз является наиболее изученным и часто встречающимся механизмом гибели клеток, который запрограммирован их природой.
В представленной работе мы впервые предложили и доказали возможность регулируемого запуска апоптоза в раковых клетках различной этимологии с использованием наноконтейнеров на основе наночастиц пористого кремния, заполненных противораковым препаратом.
С применением комплекса биологических и физических методов in-vitro показано, что сами по себе наночастицы пористого кремния не являются токсичными вплоть до очень высоких концентраций даже при продолжительных временах взаимодействия с клетками. Наночастицы имеют удельную площадь поверхности 230 м2/г, и их поры заполняются лекарством с эффективностью 48%. Таким образом, беря за факт то, что сами по себе контейнеры не токсичны, легко регулировать дозу лекарства, которое они доставляют в опухолевую клетку. Методом микро-спектроскопии комбинационного (Рамановского) рассеяния света впервые в динамике продемонстрировано, как, попадая внутрь клеток, наноконтейнеры выпускают лекарство и затем сами полностью растворяются.
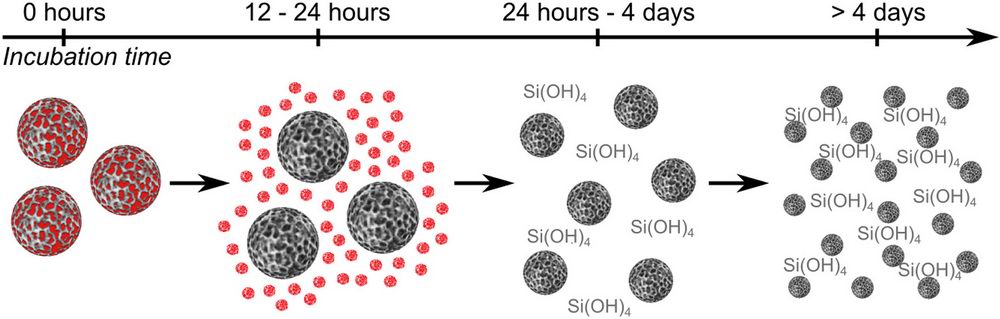
Схематическое изображение выхода лекарств и растворения наноконтейнейнеров на основе наночастиц пористого кремния, полученное по данным спектроскопии комбинационного рассеяния света [ASC BioSciEng, 2019].
При этом лекарство, введенное в клетки с помощью наноконтейнеров, оказывает больший терапевтический эффект, чем лекарство доставленное без контейнера. Апоптоз направленно запускается в клетках при воздействии на них наноконтейнеров, доставляющих относительно низкие дозы докорубицина, высокие дозы доставляемого лекарства приводят к развитию некроза, что подтверждается большим набором методологических подходов.
Полученные результаты крайне важны для развития дальнейших применений биосовместимых и биорастворимых наноконтейнеров на основе пористого кремния для апоптоз-направленной терапии онкологических заболеваний.
 Научная работа в лаборатории выполняется при поддержке 2 грантов РНФ, нескольких грантов РФФИ и «УМНИК». Аспиранты и молодые сотрудники лаборатории получили стипендии Президента и Правительства РФ.
Научная работа в лаборатории выполняется при поддержке 2 грантов РНФ, нескольких грантов РФФИ и «УМНИК». Аспиранты и молодые сотрудники лаборатории получили стипендии Президента и Правительства РФ.
Лаборатория создана на базе кафедры медицинской физики (к. 2-66 физического факультета) и кафедры физики низких температур (к. В-03, 2-06 корпуса низких температур).
Руководитель лаборатории физических методов биосенсорики и нанотераностики к.ф.м.н. Л.А. Осминкина